マネジメント人材向けのCOI e-learning・マニュアル
ホーム > 3-1. COIマネジメント体制整備
ホーム > 3-1. COIマネジメント体制整備
『人を対象とする医学系研究に関する倫理指針(平成二十六年. 告示第三号)』に基づき実施される臨床研究について実施されるCOI(以下「臨床研究COI」という)マネジメント。
大学の活動内容等(医学研究機関か、人を対象とする臨床研究を実施する機関か)によって必要なCOIマネジメント場面は異なりますので、大学の性質、実施する研究活動等に従って、マネジメントを実施する場面を決定する必要があります。
人を対象とする医学系研究を実施する研究についてのCOIマネジメントは、研究への企業の関与や経済的利益の存在によって、研究の信頼性が損なわれたり、研究対象者の保護がおろそかになることがないように、実施されるものである
研究への企業の関与や経済的利益の存在そのものが問題視されている訳ではありません。
当該研究を実施する研究者等が当該研究の実施に伴い獲得する経済的利益、あるいは当該研究が企業が製造販売する製品を研究対象とする場合には、当該企業との産学連携活動状況あるいは当該企業との一定額以上の金銭の供与もしくは株式等の取得、企業から提供される物品や施設やサービス(役務)、その他マネジメント委員会が、COIマネジメントの対象として認める行為が自己申告の内容となります。
自己申告の時期については、倫理審査において利益相反に関する情報を斟酌する必要があるので、倫理申請前までに行う必要があります。なお、倫理審査で斟酌する利益相反に関する情報に関しては、申告書類を利用する機関や、COIマネジメント委員会の決定通知を利用する機関など、機関によって異なることが調査の結果から明らかになっています。もし、倫理審査において、COIマネジメント委員会の決定通知を利用する場合には、当該決定通知を受領後に倫理申請を行うことを求める必要が生じます。
なお、自己申告の基準の具体的な基準については、現在利益相反マネジメントについては、厚生労働科学研究における利益相反(Conflict of Interest:COI)の管理に関する指針 (平成20年3月31日科発第0331001号厚生科学課長決定)を筆頭に各種ルールやガイドライン等が存在しますが、自己申告の基準については、大学等機関で決定することが求められています。
東京医科歯科大学では、1)〜3)について、「厚生労働科学研究における利益相反(Conflict of Interest:COI)の管理に関する指針(厚生労働省)・研究活動における利益相反の管理に関する規則(AMED)」の基準をベースに自己申告基準を定めています。異なる基準を定めることで、研究者が混乱することを避けるために、一律の基準にすることを心がけております。
なお、当該研究に対する研究の公正性を確認するために自己申告年度及び前年度に関する利益関係についての申告を求めています。
アンケート調査(④指針におけるCOI管理対応の実態調査I-1)の結果、87%の機関が「厚生労働科学研究における利益相反(Conflict of Interest:COI)の管理に関する指針」に準じていることが明らかとなりました。
A:産学連携活動がある
産学連携活動にかかる収入:一企業からの年間収入総額が200万円以上
産学連携活動にかかる個人収入:一企業又は一団体からの年間収入総額が100万円以上
B:産学連携活動の相手先エクイティがある。
C:企業・団体からの無償の役務提供がある。
D:企業・団体からの無償あるいはディスカウントでの機材等の提供がある。
原則研究代表者及び分担研究者となります。なお、学生や留学生、非常勤講師などであっても、分担研究者として参画する以上自己申告は必要といえます。多施設臨床研究含め外部の機関との連携に基づく研究について、研究代表者は研究全体のCOI状況について把握し、研究計画書へ記載、ICヘの明示が必要ですが、マネジメントはあくまでも研究者が所属する機関にて行われるものといえます。
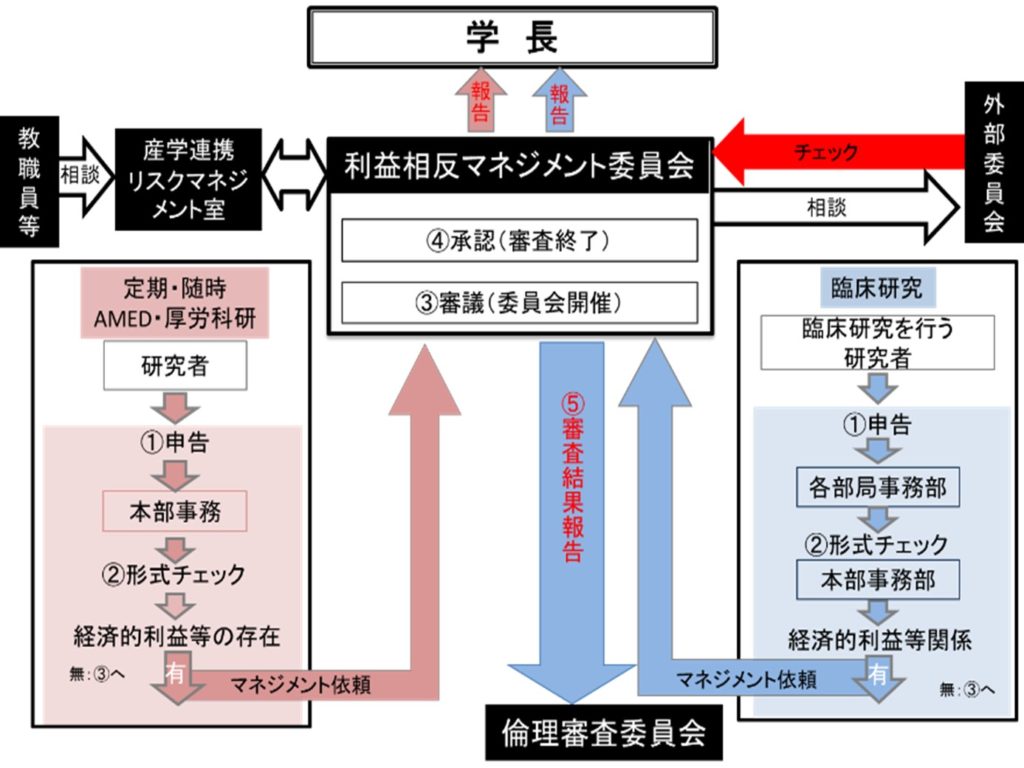
以下、参考までに、東京医科歯科大学におけるマネジメントの流れを紹介します。
マネジメント事務局、マネジメント委員の負担を配慮すると共に、2)公的研究費を用いて実施する研究に関するCOI:及び3)臨床研究COI:については、実施する研究の阻害とならないように、また自己申告含め煩雑な手続によって研究者に過度な負担が及ばないように、効率的かつ明快な流れを設定する必要があります。
以下、参考までに、東京医科歯科大学におけるマネジメントの流れを紹介します。